第五部 生命進化の物理法則
第3章 生命の原子
生命を構成している元素、つまり原子レベルの構成要素は、地球とそれ以外の惑星とで違いがあるのだろうか。
このきわめて根本的な疑問を念頭に、生命の階層をもう一つ下り、原子スケールの世界へ足を踏み入れて、物理的なプロセスが物質のより根本的なレベルで生命の構造をどのように形成し、導くのかを詳細に調査しよう。
地球の生命体は、様々な元素を基本的な分子の枠組みとして利用している。生命を構成する無数の分子の中核をなす主要な元素は、『炭素』である。炭素は周期表(図251)の6番目の元素で、その下に位置する『ケイ素』と同じグループに属し、化学的に似た性質を持っている。これにより、次の疑問が浮かび上がる。生命を構成する主要な元素として、ケイ素は炭素の次に適した元素と言えるのではないか。ケイ素は宇宙の至る所に存在するため、生命を作り出す物質として不足することはないであろう。
この質問に答え、そして生命がなぜ特定の元素を利用しているのかを理解するためには、生命を構成する原子の構造を理解する必要がある。
『周期表』と原子の物理的特性を詳細に調査すれば、生命体の構成に適した元素としての「炭素」が根ざす普遍的な物理的原理を発見できるだろう。
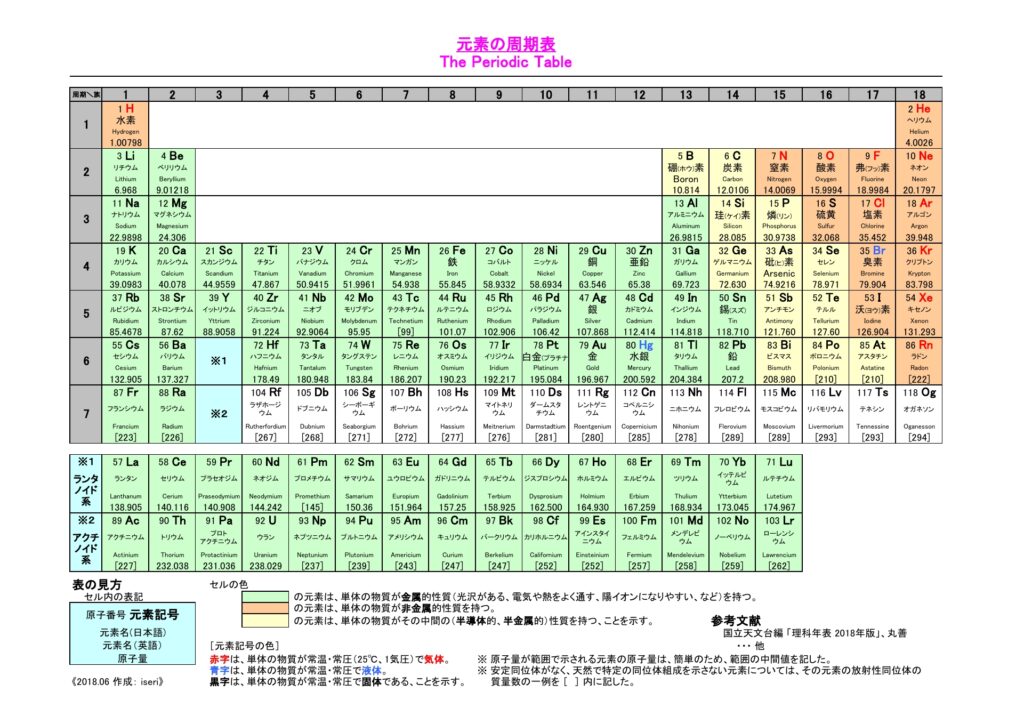
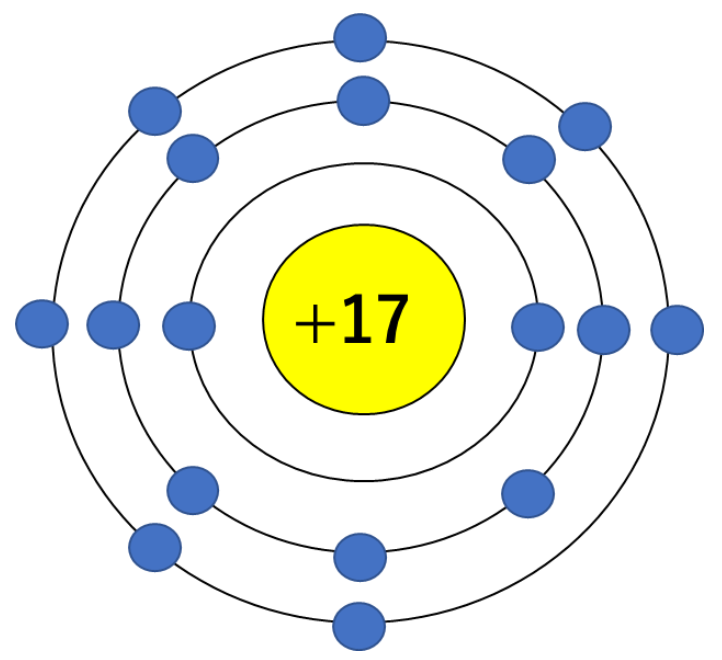
1869年にドミトリ・メンデレーエフが考案した表から発展した現在の周期表には、自然界に存在する元素だけでなく、研究室で合成された元素も含まれ、現在知られている全ての元素が記載されている。全ての元素の原子の中心には、原子核が存在する。原子核には、正の電荷を帯びた粒子である陽子の他、水素(一個の陽子のみからなる)を除く原子には中性子も含まれる。中性子は電荷を帯びておらず、原子核を一つに結びつける役割を果たしている。元素は含まれる陽子の数『原子番号』に基づいて並べられており、一個の陽子を持つ水素は原子番号が1で周期表の左上に配置されている。一方、原子番号118の『オガネソン』という発音しにくい名前の元素が表の右下に記載されている。
原子核を構成するいくつかの粒子の周りに存在するのが電子である。電子は光と同様に波のような性質を持つ粒子で、陽子とは異なり、負の電荷を帯びている。陽子の正電荷が電子の負電荷を相殺しているため、原子自体は電荷を帯びていない。つまり、原子に含まれる電子の数と陽子の数は同じである必要がある。
これまで述べた通り、周期表の左上から右下に向かって、元素の原子番号は単純に増えていく。原子核内の陽子が一個ずつ増え、その周囲を回る電子が一個ずつ加わりながら、宇宙、そして生命を構成する多様な原子が一つひとつ形成されていく。
しかしここまでの説明には、一つ小さな問題が存在する。粒子の数が増えた原子核に、電子を単純に一つずつ加えることはできない。
電子は全く同じ他の電子と隣り合うことを避ける。これは、誕生日のパーティーで隣り合わせに座らされた一卵性の双子が、個々に異なる人間として扱われることを好むのと似ている。
- 電子どうしを隣に並べることはできない。電子(実際にはあらゆる『フェルミ粒子』)が同じ状態を占めることができないというこの原理を『パウリの排他原理』と呼ぶ。これを発見したオーストリア生まれの物理学者ヴォルフガング・パウリにちなんだ名前である。
それでは、二つの電子が隣り合わせになること、同じ状態になることを避ける場合、どうすればよいのだろうか。一つの解決策として『スピン』という特性がある。電子のスピンの向き(アップスピンとダウンスピン)が異なれば、二つは異なる存在とみなされる。これは、見た目が同じ双子でも、互いに違うと感じる特徴を持つように、二つの電子はパウリの排他原理に従って共存できる。しかしながら、電子を識別できる特性はそれ以外にはないため、三つ目の電子が加わることはできない。
- 電子は二個ずつ対になり、原子に加わる。原子に加わった電子は『電子軌道』(または『電子殻』とも呼ばれる)に収まり、その中でもパウリの排他原理に従い、軌道には二個または二の倍数の電子が存在する。
- 配置が完了した電子の中でも、『最外殻に存在する電子』は、原子が他の原子と最初に接触する部分であるため、特に重要である。これらの電子は化学結合の性質や、他の原子と反応するかどうかを決定づける。
- 電子軌道が部分的にしか埋まっていない原子は、電子を得るか失うことで完全な電子対を形成しようとする。電子軌道に空きがあると、原子は反応性が高くなる。これが、生命の物質の性質を理解するための基本的な考え方である。
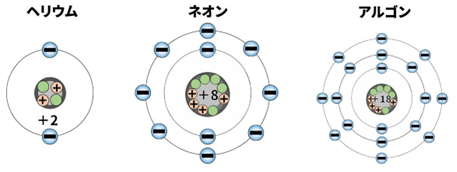
ヘリウムやネオン、アルゴン(図252)のような希ガスの電子軌道の最外殻は四つ(ヘリウムの場合は一つ)の電子対で充填されており、余地がないため、他の原子の電子を受け入れる能力がなく、活発な化学反応に参加することが困難である。これが原因で、希ガスは反応性を示さず、地味な存在になっている。
周期表上の元素1番から118番までの原子内の電子配置を調査すれば、各元素がどのように配置されているかが明らかとなる。
同じ縦の列に位置する原子群は化学的性質が非常に類似していることが認識できる。これにより、原子の特性や、原子が物質世界をどのように形成するかが、電子配置によって決定されていることが理解できる。これを決定しているのが、『パウリの排他原理』という単純な物理的原理である。
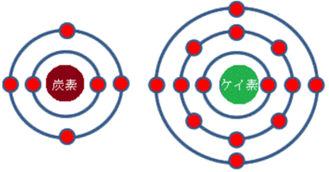
生命の話に戻って、そのほとんどの分子の根幹をなす元素、「炭素」のことを考えてみよう。含まれる電子は6つで、これら6つの電子はパウリの排他原理に従って配置される。最初の2つは最も内側の軌道である『1s軌道』に配置され、次の2つは外側の『2s軌道』に、残りの2つは同じ軌道にある『2p軌道』に入る。
それでは、炭素と同族で周期表上で炭素の一つ下に位置するケイ素の電子配置はどうなるだろうか。ケイ素の電子の数は14で、1s軌道に2つ、2s軌道に2つあるのは炭素と同じである。しかし、次の6つの電子は2p軌道の三つに入り、さらに2つは外側の3s軌道に、残りの2つは3p軌道に配置されている。ケイ素は炭素よりも電子の数は多いが、最外殻の電子は非常に似ており、2つの電子がs軌道に、さらに2つがp軌道に入っている。炭素とケイ素の化学的な性質が似ているのはこのためである。
原子やそれを構成する粒子が、生物の階層構造の最も低いレベルで、生物の中核を形成する基本原理を理解すると、炭素が生命体の構成要素として適している理由や、ケイ素が生命体を形成する可能性を探ることが可能になる。
炭素は、その大きさが結合を形成するのに適した原子である。
- 最外殻に位置する電子は、他の原子の電子と結合し分子を形成する状態にある。
- また、それらの電子は原子核に十分近い位置にあるため結合力は強く、しかしその一方で、原子間の距離も適切で、結合が容易に解ける特性を持っている。
- 生命体はDNAのように安定した分子を構築するとともに、大量のエネルギーを消費せずに、古い分子を排除して新たな分子を作り出す必要もある。炭素はこの条件に完全に適合している。
炭素原子の最外殻に位置する電子(2p軌道にある2つと2s軌道にある2つ)は、他の原子の電子と結びついて結合を形成しやすい。
- 例えば、炭素原子の1つの電子が水素の1つの電子と結合し、炭素–水素結合を形成するという、生命を構成する分子の共通の反応が存在する。
- さらに、炭素原子は他の炭素原子や硫黄、リン、酸素、窒素とも結合する可能性がある。
- これらの結合力はおおよそ等しく、炭素は結合する原子を変更するのにほとんどエネルギーを必要としない。
- 炭素原子は『二重結合』(注201)と呼ばれる結合も可能である。2p軌道にある2つの電子が、ほかの炭素原子の2p軌道にある2つと結合し、二重の結合をつくる。この能力は、三重結合を形成する能力を含めて、多種多様な炭素化合物の生成を支えている。
(注201)二重結合の例:エチレン
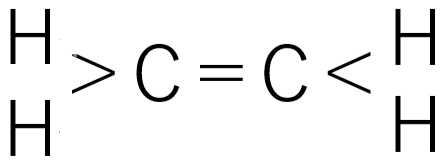
三重結合の例:アセチレン
H-C ≡ C-H
これらの多様な用途と結合しやすい特性により、鎖状や環状など、多様な構造を持つ分子が形成される。これらは、1つの炭素と4つの水素だけからなる単純な「メタン」から、2メートル以上の長さになる人間の「DNA」まで、多様である。このような多様な分子を形成する柔軟性から、他の元素でも同様のことが可能なのではないかという疑問が生じる。その答えを求めて最初に考えるのが、地球上で酸素に次ぐ豊富な元素、「ケイ素」である。これが有力な候補となり得ることは明らかである。
しかし、最外殻の電子配置が類似しているとはいえ、ケイ素と炭素には決定的な相違点が存在する。
- ケイ素には14個の電子が含まれるのに対し、炭素には6個しかない。これは、ケイ素の最外殻電子は炭素のそれに比べて原子核からの距離が遠く、結合の強度が低いことを意味する。
- 最外殻電子の結合の力が弱いために、他の分子との結合も炭素より弱い傾向が見られる。ケイ素とケイ素の結合は炭素と炭素の結合に比べて約半分の強度しかなく、自然界では、三個のケイ素原子が連続する結合はほとんど観察されない。
- 炭素を基盤とした生物では何十個もの炭素原子が連なった鎖状の分子が存在するが、ケイ素が形成できる鎖状や環状の複雑な分子はほとんどないのである。
ケイ素の電子は原子核との結合が炭素より弱いため、他の原子に取り込まれたり、他の電子と結びついたりして、ケイ素原子の反応性を高めやすい。ケイ素が形成する結合には、極めて不安定なものも存在する。例えば、『シラン(SiH4)』は、生物にとって重要な「メタンガス(CH4)」と構造が似ている分子だが、室温で自然に燃焼する。
さらに、ケイ素には弱点がもう一つある。
- 炭素原子は酸素原子と二重結合を形成し、二つの酸素と結合すると『二酸化炭素』になる。これは多様な用途を持つガスで、光合成の原料ともなる。しかし、ケイ素は炭素よりも大きいため、酸素と二重結合を形成しにくく、代わりに四つの単結合を形成する(注202)。大きい原子ではその方が配置しやすいのである。
- ケイ素と単結合した酸素原子は別の単結合を形成する余地があり、この空きを利用して別のケイ素原子と結合する。その結果、ケイ素と酸素の結合が格子状に連なった大規模なネットワークが形成される。この格子構造は、私たちに親しまれているガラスや鉱物、岩石の主成分である『ケイ酸塩』の構造である。
- だが、他の多くのケイ素化合物とは異なり、ケイ酸塩は安定性が高いため、一旦その構造に取り込まれると、長期間そこに留まる。したがって、岩石の主成分がケイ酸塩であることからも理解できるように、ケイ素を基盤とした生物の出現は難しいのである。
(注202)炭素の場合は、炭素同士で二重結合や三重結合を形成し、エチレンやアセチレンを生成するが、ケイ素は原子半径が大きく結合距離が長いため、多重結合は形成できないと一般的に考えられている。
岩石質のケイ酸塩は驚くほど多種多様である。大雑把に言って、炭素化合物にも匹敵するほどの種類が存在する。しかし、ケイ酸塩は生化学の機構ではなく、岩石を形成する物質である。安定したネットワークを形成して反応しにくいため、ケイ酸塩から作られたセラミックは、宇宙船が地球の大気圏に突入する際の熱遮蔽材として使用されている。1000℃をはるかに超える超高温にさらされても、ケイ酸塩の構造は変化せず、何ら興味深い反応を起こさないからである。
地球に存在するケイ素の大部分は、概ね反応性の低いケイ酸塩に固定されているが、生命はこの元素を避けているわけではない。
海や淡水の川、湖、池に生息する『珪藻』(注203)という藻類は、『シリカ(二酸化ケイ素)』でできた『被殻』と呼ばれる精緻な殻で身を守りながら、光合成を行って生活している。星形、樽形、船形など、多種多様な美しい造形をもった微生物である。植物もまた、シリカを集めて利用している。中には、シリカの量が全体の一割を占める植物も存在する。ケイ素はケイ酸として土壌から直接吸収され、成長や機械的強度、菌類による病気への抵抗といった点で役立っていると考えられている。特に顕著なのは『植物ケイ酸体』(注204)である。これは、細胞内に形成されるシリカの構造で、植物が重力に抵抗して成長する際の剛性を提供する。『骨片』と呼ばれるシリカの構造は、ある種の『海綿動物』の原始的な骨格としても利用されている(<物語り その9>図99)。海綿動物は地球上の多細胞生物の中でも最古の部類に入る。
(注203)「不等毛植物」に含まれる単細胞性の藻類のグループで、細胞が珪酸質の被殻で覆われるのが特徴である。被殻の形状が放射状のものを「中心珪藻」、一本の対称軸をもって左右対称であるものを「羽状珪藻」と呼ぶ。
(注204)植物ケイ酸体とは、イネ科植物などに含まれる多量のケイ酸(SiO2)が細胞組織に蓄積したもので、植物が枯れたあともガラス質の微化石となって土壌中などに長期間残存している。この植物起源の微化石はプラント・オパールとも呼ばれ、考古学分野ではこの名称が多く使われている。
一般的な科学者は、生命の基盤としてケイ素を見逃すようなことはしない。地殻の九割がケイ酸塩から構成される地球において、ケイ素は酸素と結合したケイ酸塩中で存在するだけではない。自然界に存在する『炭化ケイ素(SiC)』は、ケイ素と炭素の化合物である。また、恒星間物質では、『一窒化ケイ素(SiN)』、『シアン化ケイ素(SiCN)』、『一硫化ケイ素(SiS)』など、多数のケイ素化合物の存在が観察されている。これらの事実から、ケイ素が宇宙規模で特異な化合物を形成することが認識されている。我々はケイ素の化学的性質よりも炭素の化学的性質をはるかによく理解しており、それによる先入観を持っている。ケイ素の化学的性質の深い探求が進めば、驚きの発見がある可能性が高いのである。ケイ素原子は炭素と結合して多彩な化合物を形成する可能性があるように見える。それらの有機ケイ素化合物の中には、鎖状の構造を形成するものもある。つまり、炭素とケイ素、どちらが優れているかという二者択一の議論をしていると、炭素とケイ素の両方を利用するハイブリッドな生命体が存在する可能性を見落とすことがあるかもしれない。
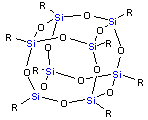
チャンスさえあれば、ケイ素はさらに有望な化合物を形成する可能性がある。その一例として、『シルセスキオキサン』というかご状の分子が挙げられる。この分子の核に様々な構造を付け加えることで、多種多様な他の分子を形成することが可能である。適切な実験室の条件下では、他のケイ素化合物から20個以上のケイ素原子を連結した長鎖化合物を形成することも可能である。
ケイ素の化学的性質を探求する旅路では、多種多様な複雑なケイ素化合物が存在することが明らかになっている。しかし、生命もただ静観しているわけではない。
- 進化の過程で、この元素を様々な機能に利用する試みがなされてきた。しかし、現在までのところ、広範囲にわたりケイ素を用いて生命の主要な分子を構築した「ケイ素ベースの生命体」は存在しないことが知られている。
- ケイ素を含む植物においても、その細胞は糖、タンパク質、脂質などの炭素化合物で構成されている。生命がケイ素を利用する場合、細胞はそのケイ素を岩石のように扱い、植物ケイ酸体や骨片などの構造を支持する素材として利用する傾向がある。
- 生命がケイ素を利用した構造は、地球上の生命が進化の過程で炭素を選択してきた歴史におけるケイ素の痕跡の一部であるかもしれない。もし生物が生存可能性を高めるためにケイ素を多くの化合物に利用するメリットを見出せば、それを活用するだろう。
- 地球における進化の実験が示すのは、この惑星の条件下では、ほぼすべての生化学反応で炭素がケイ素に勝るということである。
炭素やケイ素が属する第14族のほかの元素は、原子がさらに大きいために、さまざまな問題が生じる可能性がある。
ケイ素の一つ下に位置するゲルマニウムは、これまで生命体に利用されることはなかった。現在知られている限り、この元素はまた、生命体の構築に寄与する多様な化合物を作り出す能力を持っていない。第14族のさらに下にあるスズや鉛を利用する生物も存在するが、その生命を支える化学的な証拠は極めて少ない。
- 周期表を網羅して生命の形成に適した元素を探しても、最も多様な分子を形成する元素として、その結合の可能性の広さから炭素が群を抜いていることが明らかである。
- 地球外でも同様であり、生命のプロセスは、生命を構成する基本単位として炭素を利用する方向に収束していくと考えられる。
- そして、すでに述べたように、炭素が最適なのは「パウリの排他原理」があるからである。量子レベルで働くこの普遍的な原理が、原子内での電子配置を決定している。
しかし、我々は炭素ベースの化学反応が水と関連しているという先入観により、他の可能性を見過ごしている可能性がある。生命が利用する溶媒と主要元素の組み合わせは、他にも考慮するべきであるとの指摘もある。それでも、興味深い代替案(たとえば、液体窒素の中でケイ素ベースの生命が誕生し進化したというシナリオ、これは海王星の衛星トリトンが提唱されている)を想定しても、炭素を普遍的な観点から肯定的に見るには十分な理由がある。
- 炭素は複雑な生命体を構築する上で原子物理学的に有望な性質を持つだけでなく、
- 多種多様な分子を形成する傾向がある。
- さらに、宇宙全体で炭素化合物が豊富であるため、仮に地球外で生命の進化が起きたとしても、その最初期の段階で、複雑性を獲得する上で最も容易に手に入る分子として炭素化合物が選ばれる可能性が高いのである。
宇宙を無限に続く空虚と捉える視点は不適切であるとは言えない。少なくとも、この小さな地球に存在する多種多様な物質に比べれば、そのような見方になるかもしれない。夜空に点滅する小さな光が恒星であり、その周りを囲む漆黒の空間が宇宙の虚無であると我々が認識して以来、その意識が多くの人々を占めてきた。
しかし、広大な宇宙が不毛な空間であると考えてしまうと、一見空虚な宇宙空間で繰り広げられている驚くほど複雑な化学反応を見過ごすことになるだろう。
ビッグバンが宇宙の誕生を告げた時点では、状況は比較的単純であった。温度が下がるにつれて、化学反応は主に水素、ヘリウム、リチウム、そしてそれらのイオン間で生じ、一定の電子と放射線が放出された。要するに、これらの元素の再配置が行われる基本的な場となった。その後、ガスの渦が形成され、それが重力によって集合し密度が増すと、恒星の核融合反応が始まった。その輝く球体の内部では、水素原子が結合し、炭素などのさらに重い元素が形成された。『小質量星』と呼ばれるこれらの恒星の中には、活動が落ち着き、最終的に燃料が消耗し、『白色矮星』という形で静かな余生を送るものも存在する。しかし、内部で元素が玉ねぎのように層をなす大型の恒星の中には、重力がガスの圧力や外向きの熱エネルギーを圧倒し、大爆発を引き起こし、物質を吹き飛ばすものも存在する。これが『超新星爆発』である。このような大爆発によって、周期表上で鉄よりも重い元素が新たに生成され、宇宙へと散布される。
生命に欠かせない元素の起源については、19世紀と20世紀の天文学者による研究により理解が深まった。炭素などの多くの軽い元素は主に小質量星と大質量星の核内で生成されるが、モリブデンやバナジウムなど一部の生物に必要な他の多くの重い元素は超新星の内部で合成される。
元素がどのように形成されたかを理解したことにより、生命と宇宙との関係についての視点が大きく進化した。天文学的な知識を得て、生命に関連する元素の起源を理解し、宇宙の物理的性質を生物の原子構造と関連付けることが可能となった。このような理解が進む中で、生命の起源が宇宙にあるという考え方は、一部で不可解な点がある一方で、新たな発見を提供している。我々全てが星屑であるという視点は常套句になってしまっているが、それが我々が現代の宇宙論や天文学の理解を当たり前のものと受け入れている現状を示しているかもしれない。
暗黒の空間を望遠鏡で観測する際には、我々が見ることができるスペクトルの範囲(可視光)ではなく、赤色光の先にある肉眼では捉えられない赤外線を特殊なセンサーで観測し、そのデータを我々が視認可能な形に変換することができる。赤外線データを分析することにより、漆黒の闇に渦巻いている物質や無尽蔵に噴出するガス、夜空を覆う巨大なガス雲を観測することが可能となる。かつては暗黒にしか見えなかった場所でも、物質を観測できるようになった。
このように視認可能になった物質の大部分は、『希薄な星間雲』と呼ばれる。その名前は、その内部のガス濃度が1立方メートルあたり約108個の分子やイオンで表されるからである。これはかなり多く感じられるかもしれないが、我々が吸入する空気中の分子数は1立方メートルあたり約2.5×1025個であるため、それに比べるとはるかに少ない。
- 『希薄な星間雲』に含まれる物質の量は、地球上の実験室で再現できる真空よりも少ない。しかし、星間雲の中にも、驚くべき化学反応を起こす物質が存在している。地球上の実験室ではなかなか見つけられないが、実験室で再現した真空よりも物質の量が少ない星間雲には、興味深い化学反応を起こすような物質が豊富に存在している。それらは、放射線であり、陽子、電子、ガンマ線、紫外線、さらには鉄やケイ素など多くの重い元素のイオンが星間空間に散乱している。
- この放射線がイオンや分子の希薄な集団にエネルギーを供給する。これが十分に大きくなると、分子は分解され、活動的になり、さまざまな反応を引き起こして新たな化合物を形成することが可能になる。星間雲はおおよそ-180℃と極めて冷たいが、放射線がイオンや分子に衝突することにより、化学反応を引き起こすことができる。
天文学者たちは、星間雲における化学反応の生成物の観察に、『分光法』という手法を活用している。希薄な星間雲を光が透過する際、存在する化合物が光の一部を吸収する現象が発生する。より詳細に述べると、電子が光のエネルギーを吸収し、高いエネルギー準位へと移動する。その結果、電子は光のスペクトル内で不明瞭な隙間を形成する。星間雲を透過した光のスペクトルは地球上の望遠鏡によって捉えられ、そのデータが分析される。『吸光分光法』と呼ばれるこの方法により、星間雲の化学成分が特定される。また、電子が光のエネルギーを吸収し、再放射した場合、異なる波長の光を放つ可能性があり、これもまた特定の化合物を検出する手がかりとなる。この二つの分光法を活用することで、星間雲を構成するすべての化合物を特定することが可能である。しかしながら、これら先進的な手法の結果を解釈するための知識は、現在もまだ発展途上である。星間雲では無数の光の吸収や放射が起きており、その起源は部分的にしか明らかになっておらず、あるいはまだ全く理解されていない。星間雲のスペクトルに観察される各種の吸収の痕跡は「ぼやけた星間線」と呼ばれ、多くの痕跡を含むが、それをどのように説明するべきかはまだ確定していない。
星間雲は依然として多くの謎を抱えているが、これまでにCO、OH、CH、CN、そしてCH+イオンといった単純な化合物が多数特定されている。まだ特定されていない化合物も多数存在するが、これらの化合物を見ると、一つの特徴が明らかになる。それは、炭素を含む化合物が圧倒的に多いという事実である。炭素は、小質量星と大質量星における核融合反応で生成され、その後、宇宙空間へと放出され、星間雲内で他の多くの元素と反応し、単純な化合物を形成する。これには有機炭素化合物の初期段階の構造が含まれている。
宇宙にはさらに大きく、活動的な星間雲も存在する。このような他の天体を観察すると、調査がさらに興味深くなる。
「巨大分子雲」と呼ばれるガス雲が宇宙の至る所に存在する。中には幅が150光年にも達する分子雲が存在し、その質量は太陽の1000倍から1000万倍にも及ぶ。これらの場所は新しい恒星の「保育園」であり、ガスの密度が相対的に高いため、渦を形成し、新たな球体が核融合を始めることが可能となる。1立方メートルあたりのイオンや分子の数は1兆個ほどで、希薄な星間雲よりもはるかに多い。地球の大気と比較してはるかに少ない量であるが、それでも興味深い化学反応を引き起こすには十分な密度である。
こうした分子雲に含まれている物質の密度はある程度高いので、新しい恒星やほかの天体が放つ紫外線の大部分が遮られる。化学反応を促す放射線の量は少ないかもしれないが、その一方で、形成された化合物がその同じ放射線によって分解されにくくもなる。
巨大分子雲の内部では、HCOOH、C3O、C2H5CN、CN、CH3SH、C3S、NH2CNを始めとする100種類を超える化合物が検出されている。全体像は今後さらに詳細に明らかになると期待される。この恒星の保育園では、一個または二個の原子を含む単純な分子だけでなく、さらに興味深い構造も見られる。希薄な星間雲で観測されている化合物も驚くべきものだが、巨大分子雲ではそれがさらに進化しており、炭素化合物がより複雑になっている。巨大分子雲は炭素ベースの化合物に満ちているのである。
実際には、分子雲が有する複雑さは非常に大きく、数個の原子からなる化合物だけでなく、さらに複雑な構造が存在する。例えば、ベンゼンなどの六個の炭素原子の環状構造は、互いに連結して『多環芳香族炭化水素』を形成する。さらに興味深いことに、六個の炭素原子からなる環状構造は、実験室での反応により、『キノン』(注205)という物質も形成することができる。これは、生物が周囲の環境からエネルギーを集める際に電子の運搬に利用される分子である。こうした実験室での反応は、星間物質に含まれる分子が既に、生物のエネルギー生成機構と代謝経路に役立つ前駆体への道を歩み始めていることを示している。これは極めて興味深い事実である。
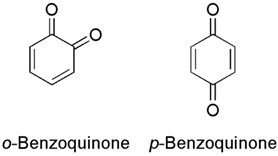
(注205)キノンとは、ベンゼン環の水素2原子を酸素2原子で置換した形の化合物の総称である。ベンゼン環が一つのベンゾキノン、二つのナフトキノン、三つのアントラキノンなどがあり、パラとオルトの異性体が存在する。色が濃いものが多く、合成染料の原料になる。狭義にはパラベンゾキノンを指す。
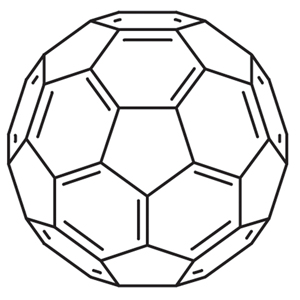
こうした炭素の連なりはさらに特異な分子をつくると考えられている。炭素の環状構造を三次元的に組み合わせると、炭素の球状分子が生成できる。その一例が、炭素原子を60個含んだ『バッキーボール』である。『C60』という分子式で表わされるこの分子は、炭素原子が形成する20個の六角形と12個の五角形が球状に結合し、サッカーボールのような形状を示している。こうして形成された球状分子が融合し、タマネギのような層状の炭素構造を形成する。つながり合った炭素原子がチューブや格子を形成し、様々な構造の組み合わせを探る。
宇宙規模での化学反応がどのように生じ、どのような物質が生成されるかを探求する研究は、革命的ともいえる素晴らしい成果をもたらしているが、多様な化合物がどのように形成されるのか、その過程は依然として科学者たちを困惑させている。特に困難で重要な問題は二つ存在する。
- 第一に、化合物が反応を起こすには、それらが互いに近くに存在する必要がある。例えば、硫酸を水で薄めるとめぼしい化学反応が起きなくなり、薄めた硫酸と砂糖を混ぜても弱酸性の砂糖水ができるだけで、化学の授業で生徒たちを沸かすような反応は何も起きない。分子雲では、分子やイオンの密度が地球の大気に比べて遥かに小さいにも関わらず、どのように化学反応を起こすことが可能なのだろうか。加えて、分子雲の温度は非常に低い。
化学の授業で学んだように、化学反応を起こす最も直接的な方法の一つは加熱である。マグネシウムの金属片をただ実験室の作業台に置いておくだけでは何も起こらないが、それをブンゼンバーナーの炎にかざし、473℃を超えるまで加熱すると、マグネシウムは発火し、眩い白色の光を放つ。
- それに対し、マイナス260~マイナス230℃の分子雲では、化学反応を起こせる可能性は明らかに低い。しかし、驚くべきことに、このような場所でも化学反応は生じている。
- 分子雲には、シリカ(SiO2)や炭素が豊富な物質が氷に覆われた、『星間塵』と呼ばれる微粒子が存在する。分子雲に含まれているイオンや分子は、そうした微粒子に付着して集合することがある。これが、イオンや分子を寄せ集めるメカニズムの一つである。このメカニズムがなければ、イオンや分子は無目的に星間空間を漂い続けることになるだろう。分子雲での化学反応の大部分は、このような微粒子で生じると宇宙化学者たちは考えている。微粒子の一つひとつが有機化合物の工場、さらに言うなら、微小な原子炉の役割を果たしているのである。
宇宙に存在する炭素の量は膨大で、中には炭素が特徴の恒星さえ存在する。これらの『炭素星』の周辺では、炭素化合物の形成、破壊、再構成などの多数の反応が生じており、有機化合物の複雑性と多様性は計り知れない。地球から390~490光年の距離には、『ハロー』と呼ばれる光の輪を伴った恒星が存在する。これは、秒速50キロを超える速さで広がる物質の『エンベロープ』を示す痕跡である。このエンベロープ内では60種類以上の分子が検出されており、その中には直鎖状や環状の構造を持つ炭素分子も見つかっている。これは有機化合物が宇宙空間に放出される現象である。その恒星が放つ光の領域、すなわち『光球』の周囲では、一酸化炭素(CO)やシアン化水素(HCN)といった単純な化合物が検出されている。
以上の観察から、いくつかの明らかな点が浮かび上がる。
- まず、宇宙は化学反応が起きない冷たい場所ではない。
- また、恒星が銀河の中心を単に漫然と周回し、生命の原料となる周期表の基本元素を生み出すだけではない。複雑な化学反応は宇宙の至る所で、どれほど希薄なガス集団でも起きている。
- そして、そこで生成される化合物には、炭素と他の元素が多様な配置で結合して形成される多種多様な有機化合物も含まれている。
これらの観察から、複雑な炭素化合物の生成において特異な必然性が見えてくる。
- 炭素が他の元素と様々な形で結合し、多種多様な分子を生成する性質は、地球上の特定の温度や圧力の条件下でのみ見られる特異なものではない。生命を構築する複雑な世界で炭素が中心的な役割を果たすのは、特殊な惑星環境に限られた事例ではない。
- 宇宙で最も寒冷な場所でも、炭素は他の炭素を含む周期表に載っている元素と結合し、地球上の生命を形成しているさまざまな有機化合物を生成する。
- 生命を構成する炭素化合物への道のりは、普遍的であるように思われる。
この観点から見ると、最も興味深い疑問は、
- この化学反応でどの程度生命の先駆けとなる分子が形成されるかということである。
生命を構成する基本的なモノマー(単量体)、例えばアミノ酸、糖、タンパク質を作る核酸塩基(注206)、炭水化物、遺伝暗号などを探し出す試みは全てが成功したわけではなかった。
(注206)核酸塩基とは、核酸を構成する成分「塩基」で、炭素、水素、窒素、酸素からなり環状構造になったものを指す。核酸をつくる塩基には、「プリン塩基」と「ピリミジン塩基」の2つが存在し、プリン塩基はアデニン(A)とグアニン(G)、ピリミジン塩基はシトシン(C)、チミン(T)、ウラシル(U)である。
コペンハーゲン大学の研究チームは、新たに形成されつつある恒星に近い星間物質中で『グリコールアルデヒド』を発見した。この分子は、最終的に糖を生成する化学反応『ホルモース反応』(注207)に参加することができる。星間物質中では、アミノ酸の前駆体となる化合物『シアン化イソプロピル』も発見されており、また、『ホルムアルデヒド(CH2O)』の存在も確認されている。この化合物は、アミノ酸などの化合物につながる化学反応に参加すると予測されている。
(注207)ホルムアルデヒドから糖を合成する化学反応で、アレクサンドル・ブートレロフによって1861年に発見された。
星間雲では、HCNなどの単純な化合物と比べて複雑な分子は少なく、その発見はより困難である。観測手法の進化に伴い、複雑な分子の発見は増えてくるであろう。しかしながら、全体的な結論は明確である。
- 星間物質には、生物を構築する化学合成の前駆体や中間生成物として機能しうる多数の炭素化合物が含まれているということである。
- 生命を構成する基本要素が宇宙で生成しうることを示す証拠は、『星間物質』よりも身近にある『隕石』でも見つけることができる。これもまた、説得力のある驚くべき手がかりである。
- 炭素質の隕石で見つかる70種類以上のアミノ酸の濃度は低いものの(およそ10~60ppm)、アミノ酸の存在自体は、太陽が形成されるもとになった原始惑星状星雲が、炭素の化学反応に適した場所だったことを示している。
これまでのところ、隕石で見つかったアミノ酸が集まって単純なタンパク質の鎖を形成した証拠はない。初期の太陽系の状態はアミノ酸の形成に適していたように見えるものの、それ以上の複雑性は獲得できなかった。こうした構成要素がつながって、生命に関連する複雑な分子の鎖を形成するには、惑星の表面を覆った水の環境という、もっと穏やかな条件が必要だったのである。
隕石にアミノ酸が含まれていることから、星間空間でアミノ酸が検出されない理由が疑問に思われるかもしれない。その一つの理由として、アミノ酸の濃度が低く、隕石からは実験室で容易に検出できても、星間物質では、他の多数の化合物の痕跡によって検出が困難であると考えられる。また、初期の太陽系に存在した原始惑星系円盤がアミノ酸の形成に特に適していたとも推測される。反応に利用可能な天体の表面が近くに無数に存在し、温度勾配、水などの揮発性物質が存在するため、原始惑星系円盤は、生命の構成要素をもたらす反応の一部に適していたのかもしれない。
隕石はアミノ酸以外にも多数の化合物を含んでいることが明らかになってきた。『炭水化物』や『核酸塩基』(遺伝暗号の文字)の構成要素である『糖』が、『スルホン酸』や『ホスホン酸』などと混在して隕石中で発見されている。『タンパク質』、『炭水化物』、『核酸』、『膜脂質』(注208)という、生命を構成する四種類の主要な分子群や、そのモノマーは隕石中で検出されてきた。
(注208)「膜脂質」は、細胞の二層構造表面(脂質二重層)または一重層を形成する化合物の一群であり、構造的には油脂に類似している。動物における膜脂質の三つの主要なクラスは、「リン脂質」、「糖脂質」、「コレステロール」である。脂質は両親媒性を持ち、水に溶ける末端(極性)と、脂肪に溶ける末端(非極性)を持っている。膜脂質は、極性のある端が外側を向き、極性のない端を内側を向いた二重層を形成することで、非極性部分が水と接触しない脂質二重層を形成し、水を含んだ細胞内部と水を含んだ細胞外部を分離することが可能である。
- ここで重要な点は、隕石から複雑なケイ素化合物が見つかっていないことである。
- もし複雑なケイ素化合物が存在するなら、隕石が惑星に落下した際に、炭素ベースの生命が生まれる可能性とケイ素ベースの生命が生まれる可能性の間でせめぎ合いが繰り広げられることだろう。
- しかし、隕石中に存在するケイ素化合物は、反応性の低いケイ酸化合物が圧倒的に多い。隕石は複雑な炭素化合物の普遍性を示している。
隕石は太陽系の形成に伴い生じた岩石質の残骸、すなわち『小惑星』に由来するが、同等に重要な存在は『彗星』である。「彗星」は、地球から約2万~10万天文単位(注209)離れた領域に位置する球形の領域『オールトの雲』に集まっている。海王星の軌道の先にある『カイパーベルト』にも、氷の天体が集まった帯状の領域がある。彗星は小惑星と同じように、太陽系形成の残骸だ。岩石と氷が混合した天体であり、その黒っぽい核は部分的に有機化合物によって形成されると推測されている。彗星もまた、炭素化合物の形成という独特な物語を伝えているのである。
(注209)天文単位(記号: au)は、長さの単位で定義定数であり、正確には 149597870700 m である。地球と太陽の平均距離に由来し、主として天文学で用いられる。
これまでに、望遠鏡や探査機を用いた観測により、氷に包まれたこれら小さな世界を詳しく見る機会が与えられてきた。彗星は単なる氷の塊ではなく、一酸化炭素や二酸化炭素だけでなく、メタンやエタン、アセチレン、ホルムアルデヒド、ギ酸、イソシアン酸などの複雑な化合物を含んでいる。特に、彗星67Pでは欧州宇宙機関の彗星探査機ロゼッタがアミノ酸の『グリシン』を検出した。グリシンの存在がわかったことで、生命に必要な他のアミノ酸や分子が彗星に存在する可能性が浮かび上がってきた。
太陽系でこのような現象が起きているとしたら、ここが宇宙でもきわめて特殊な場所ではない限り(そう考える理由はないのだが)、宇宙のほかの場所でも起きているということである。銀河系の外、アンドロメダや地球から数百万光年離れた場所では、アミノ酸や糖、核酸塩基、脂肪酸が惑星に降り注いでいる。有機炭素化合物は普遍的なものであり、したがって、宇宙のほかの場所で生命が生れたとすれば、それは炭素ベースになる可能性が高い。
驚くべき宇宙の発見にも関わらず、我々の惑星上で生命に必要な化合物の一部が形成された可能性を見過ごしてはならない。エネルギー豊かな環境で複雑な炭素化合物が生成されることは、スタンリー・ミラーとハロルド・ユーリーによる1950年代の研究により明確に証明されている。
まだ炭素化合物が宇宙や隕石に豊富に含まれているとの知識がなかった頃、『ミラーとユーリー』は『原始スープ』から自己複製する生命体への重要な移行がどのように進んだのかを化学的に解明しようと研究し始め、実験室で次のような簡潔かつ見事な実験を行なった。メタン、アンモニア、水素を含んだガスを容器に入れ、水蒸気を循環させる。そこに、初期の地球の雷に見立てて、二本の電極で放電させる。こうしてガスにエネルギーと水を加え、初期の地球をシミュレーションした結果、モンスターではなく、どろりとした茶色い液体が出現した。そこにアミノ酸が含まれていた。グリシン、アラニン、アスパラギン酸など、数多くの化合物が合成されたのである。しかし、この実験で使われたガスは、初期の地球の大気にそれほど多く含まれていなかったと今では考えられている。最初に使うガスの組成を変えれば、結果としてできるアミノ酸やほかの化合物の種類も変わる。
とはいえ、
- エネルギーと数種類の単純なガス、適量の水を混ぜればアミノ酸が形成されるという概念は、生命を構成する有機化合物が奇跡的に生まれたものではないという認識を確立する上で重要な役割を果たした。
- 事実、炭素原子を含むガスの混合物にエネルギーを加えた時に複雑な有機化合物が生成されないようにすることは、極めて困難である。
- 『ミラーとユーリーの実験』では、有機化合物が宇宙だけでなく、若い惑星の表面でも形成されうることが立証された。有機分子が星間空間や惑星の表面で形成されることが、これではっきりした。
- 若い惑星は、多種多様な有機化合物が集まり、生命に利用可能な形になる場所、すなわち「るつぼ」のような場所なのである。
適度なエネルギーと基本的な材料が揃っている場所で複雑な有機化学反応が発生する傾向は、土星の衛星タイタンで見られるあらゆる有機化学反応が見事に実証している。タイタンのメタン湖は、宇宙において有機分子が生成される源泉である。茶色く霞みがかかったその大気は、上層部で大気中のメタンが紫外線と反応し分解することで遊離基が形成され、それが後にエタンや有機化合物の複雑な鎖に変形し、その一部が大気の上層を漂い独特な色を放っている結果である。
このような物質の大部分はタイタンの表面に降り注ぎ、広大な有機化合物の砂漠を形成している。タイタンには、複雑な有機化合物の砂丘が長さ数百キロにわたって表面に連なり、その高さは100メートルにも達している。エタンはC2H6という分子式で表される炭化水素で、多くの複雑な分子の前駆体となる。太陽系が誕生して以来タイタンの表面で起きている現象が継続していれば、エタンの層の厚さは理論的には約600メートルにもなると考えられる。
タイタンに存在する多種多様な有機化合物の中に、生命の構成要素も存在するかどうかは、現時点では明確にはわかっていない。将来的にタイタンで無人探査が行われれば明らかになるかもしれないが、何らかの答えが出たとしても、メタンと適度な放射線が存在する衛星で広大な砂丘、湖、大気中の有機化合物の霞が形成されるという観察結果は揺るがない。
地球で炭素化合物が生命を生み出すのに最適な条件が揃っているのは、特殊な事象であるとの見解もある。しかし、ここまで述べてきた観察結果からは、それとは全く反対の考え方が示唆されている。
- 地球からかけ離れた環境でも、炭素は反応性が高く、多目的に利用可能な化合物を無数に生成している。様々な温度、圧力、放射線の条件下でも、炭素は周期表のあらゆる元素の中で最も多様な分子を生み出している。
もちろん、他の化合物も発見されている。星間空間でのケイ素と炭素の結合やケイ素と窒素の結合が検出されていることから、地球外の環境では、地球上ではまれにしか見られない種類の興味深い結合が形成される可能性があることが示されている。これらの事例を見ると、私たちが持つ化学の知識がいかに限定的であるか、再認識する機会となる。
- それにもかかわらず、これらすべてのデータを通じて明らかなのは、多様な炭素化合物の存在である。これは地球上で見られるこうした構造が特異なものではないことを示している。
- 地球が果たしている役割は、炭素化合物が長鎖を形成し、自己複製する存在へ進化するための環境を提供していると考えられる。この過程では、ガス雲や凍てついた砂丘では容易には得られない特殊な条件が必要になるだろう。
- しかし、この現象が起きている宇宙全体を見ると、炭素化合物はあらゆる場所で一般的に形成されている。
炭素以外の元素に目を向け、生命で広く利用されていると知られている他の元素について考察すると、さらに興味深いストーリーが見えてくる。
- 生命を形成するためには炭素以外の原子も必要である。利用可能な全ての原子の中で、炭素と結合してより複雑な構造を形成するものは、『水素』、『窒素』、『酸素』、『リン』、『硫黄』の五つの原子である。これらの原子は炭素を含め、『CHNOPS』という易しくない表現で呼ばれることがある。
なぜこれらの原子なのか?それらが生命の至る所で使われているのは、単純な物理法則が働いた結果なのだろうか。
- これらの元素の振る舞いもまた、炭素と同じように、パウリの排他原理の影響を受けている。
- 水素は常に他の原子と結合できる状態にあり、一つの電子を受け取ることで電子対が形成され、その唯一の電子殻が満たされる。水素は生物の体内の至る所で炭素と結合している。大まかに言えば、水素は利用可能な単一の電子を収集する役割を果たしていると見ることができる。これが水素が生命体の至る所に存在している理由である。
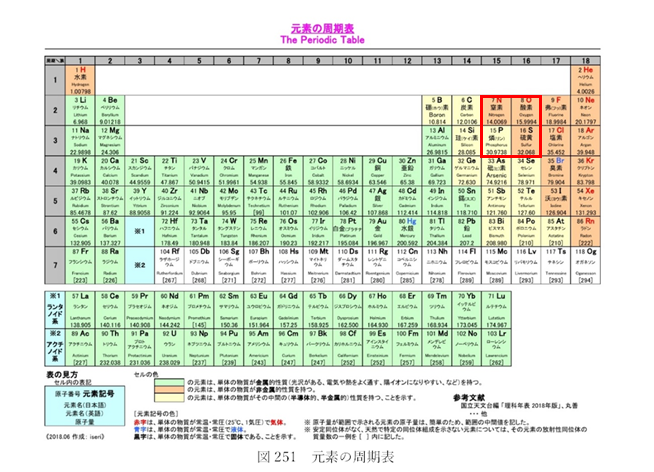
他の四つの元素(窒素、酸素、リン、硫黄)は生物の炭素ネットワークで、ボルトやナットのように生物を一つにまとめる役割を果たしていて、興味深いことに、周期表でも炭素の近くに寄り集まっている(図251参照、赤枠を付けて再掲)。化学的な視点から考察すると、この密接な関連性がどのように形成されたのかの理解が深まる。
- これら四つの元素はすべて電子軌道に空きがあり、他の原子との結合に参加することで、その空きを埋める。
- 周期表での位置によると、これらの原子の大きさは結合に適しており、これらの電子が形成する結合は、分断時に過大なエネルギーを必要としないため、絶え間なく結合や分解を行わねばならない生物の形成や成長において、便利に活用される。それにもかかわらず、これらの原子の電子が結合する力は十分で、結合は一般に安定である。
- 全体的に見ると、これら四つの元素は多様な性質を持つ化合物を高い効率で形成する能力を有している。炭素と結合すると、生命体の繁殖と進化を円滑に進めるために必要な多種多様な化学反応を促進する。
一見すると、窒素は生命に利用される元素としてあまり有望でないように思える。窒素原子は他の窒素原子と三重結合を形成し、非常に強く結びつく。そうして形成された窒素ガス(N2)は、地球の大気の78.1%を占める。しかし、いわゆる窒素固定菌がもつ触媒や、雷などの非生物的な作用により化学的な束縛から解放されると、窒素は炭素と多種多様な有益な結合を形成することが可能となる。
- 安定な構造の一つには、窒素原子が二つの炭素原子間に位置するものがある。これは個々のアミノ酸を連結し、タンパク質を形成するための「ペプチド結合」(図257)である。全てのアミノ酸が窒素を含むため、このように連結することが可能である。
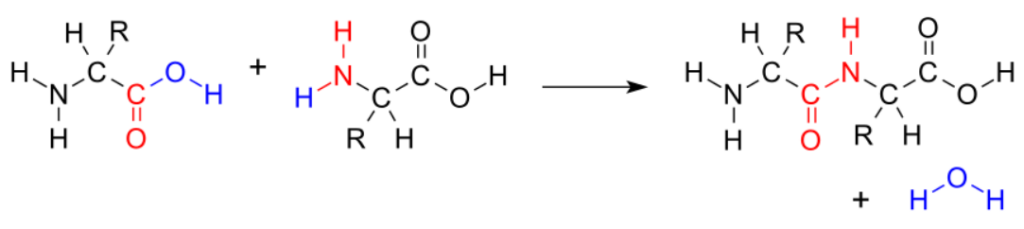
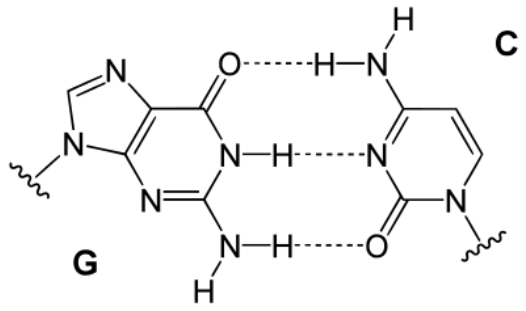
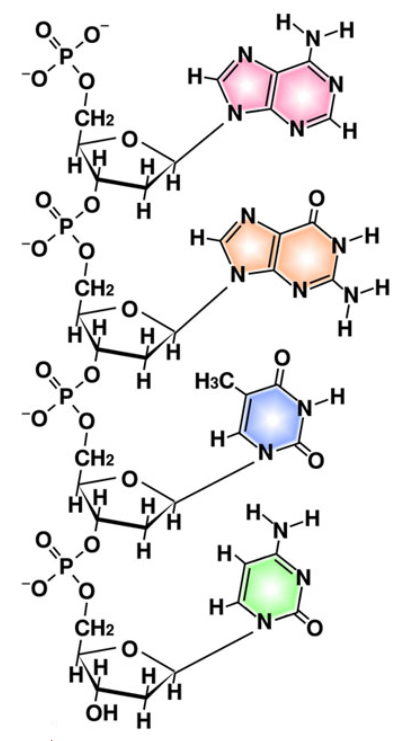
- 窒素はまた、炭素原子間に配置され、環状構造を形成する能力も有している。これはDNAの「塩基対」(注210)をはじめ、生物で利用される主要な環状分子の多くに含まれている。核酸に含まれる窒素は、バックボーンを形成する糖の連結部位として機能し、遺伝暗号全体の統合を支えている(図259)。
(注210)『塩基対』とは、デオキシリボ核酸の2本のポリヌクレオチド分子が、アデニン (A) とチミン (T)(あるいはウラシル (U))、グアニン (G) とシトシン (C) という規定されたペアを形成し、水素結合で連結するものである。この組み合わせはジェームズ・ワトソンとフランシス・クリックが発見したもので、『ワトソン・クリック型塩基対』あるいは『天然型塩基対』と呼ばれている。
ここで周期表のさらに右側に目を向け、酸素について考えてみよう。酸素はあらゆるところに存在し、動物に欠かせないこの気体は、周期表で窒素の隣に位置している。
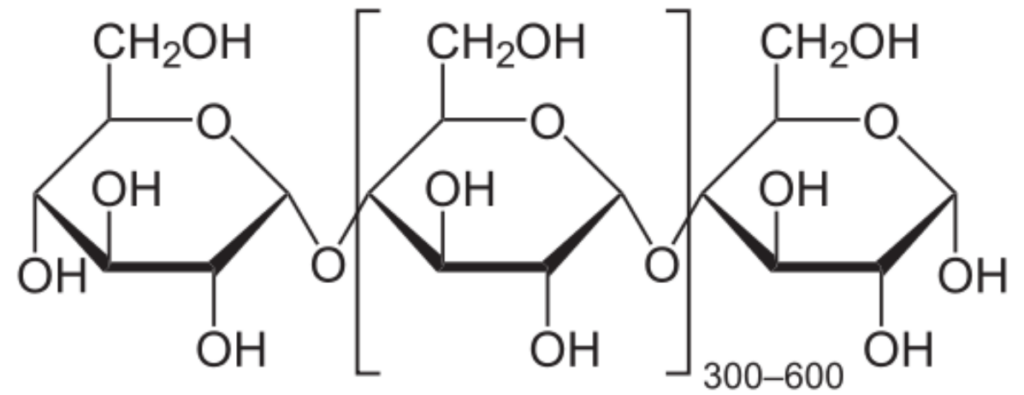
酸素原子は炭素原子と結合し、環状構造を形成したり、糖などの炭素を含む分子どうしを連結し、糖分子が長く連なる炭水化物を形成するという、窒素と類似の機能を果たす(図260)。酸素を含む糖は、生命に欠かせない核酸のバックボーンの一部となる(図259)。カルボン酸を含むタンパク質等の複雑な分子の合成に関与するだけでなく、多くの有機分子にも酸素は含まれている。
最後の二つ、リンと硫黄は、周期表上でそれぞれ窒素と酸素の下に位置し、電子の数が多いため、原子も大きい。
リンはマッチの先端に存在する燃焼材料としてよく知られているが、多くの生物に不可欠な分子にも存在している。リン原子は他のCHNOPS元素より大きく、最外殻の電子が結合の形成と切断を行ないやすいので、生物の体内においてエネルギーの必要な反応の多くで主要な成分の一つとなっている。酸素との結合は必要に応じて解かれ、加水分解反応ですぐにエネルギーを放出できる。『ATP』は酸素原子と交互に連なったリン原子を三個含み、地球上の全生物でエネルギーを蓄える分子の一つとなった。生命にとって小さなバッテリーのようなものである(<物語り その4>図40参照)。
リンは多岐にわたる用途を持ち、細胞の構造にも不可欠である。細胞膜を構成する長鎖の炭化水素、脂質の先端部にもリン原子が存在する(<物語り その19>図247参照)。さらに、リンは遺伝情報の核であるDNAにも豊富に存在している。DNAの骨格を追跡すると、リン原子が糖分子間を接続し、全体の構造を維持し、DNAの寿命を延ばす役割を果たしている。負の電荷を持つ酸素原子がリン原子から引き出されているため、DNAは負電荷を帯び、細胞膜の内側に存在する負電荷と反発して細胞内に留まることが可能となっている(図259参照)。この負電荷はまた、DNAの加水分解を防ぐ効果があり、その分子の安定性を高めている(注211)。
(注211)DNAは「デオキシリボ核酸」、RNAは「リボ核酸」で、どちらも非常に似通った化学構造を持つが、ほんの一つ、デオキシ構造(水酸基-OHがない)の差異だけで(<物語り その20>図250参照)、物質としての安定性が格段に違ってくる。DNAは化学的に安定的で、RNAは化学的に不安定、分解を受けやすいのである。DNAは情報担体として安定的である必要があるが、RNAは情報の運び屋なので、細胞にとってむしろ不安定なほうが都合がよい。なお、「デオキシ」の「オキシ」とは、水酸基(-OH)ということで、「デ」とはそれが外れていることを表す。つまりデオキシリボ核酸(DNA)とは、「リボ核酸に存在する水酸基がない核酸」という意味である。そして、水酸基があるとその酸素原子が周囲の電子を引きつけ、電子の不均衡は物質の不安定さを増大させる。つまり、水酸基があるとその物質は分解や化学反応を受けやすくなる。RNAが不安定で、DNAが安定とはこのような事実に基づいている。リンからぶら下がっている酸素原子が負の電荷を持つと、周囲の電子の引きつけを弱め、分子の安定性を一層高めているのである。
周期表でリンの右に位置する元素は硫黄である。硫黄は「燃える石」とも形容され、活火山の火口を飾る黄色い物質である。リンと同様に炎や野性的なイメージを思わせる元素ではあるが、生物にとっても有用な役割を果たしている。
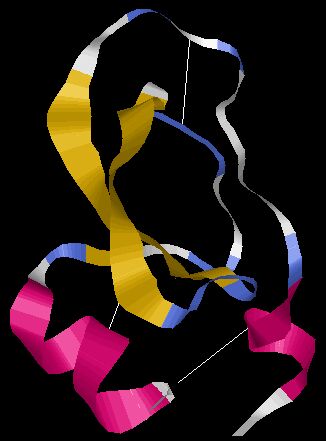
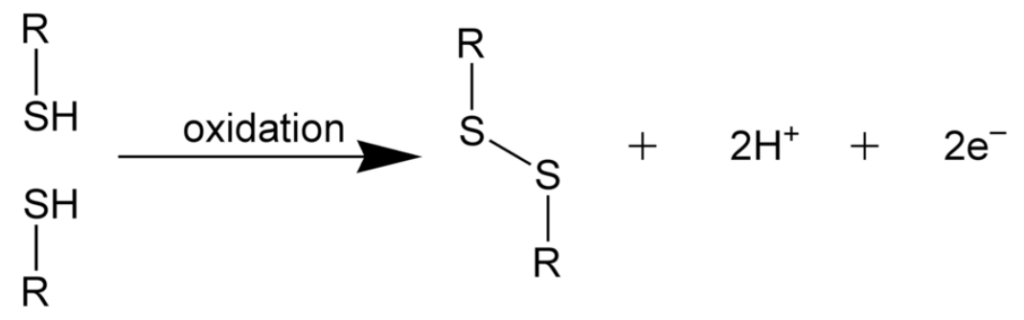
硫黄はタンパク質の構成要素として存在し、タンパク質を構成するアミノ酸の長鎖の異なる部位に硫黄を含むアミノ酸が二つ存在し、これら二つの硫黄原子が隣り合って『ジスルフィド結合』を形成する。この結合は、鎖の様々な部分を接続し、明確な形を作り出すことでタンパク質の三次元構造を整える役割を果たしている。これにより、タンパク質は細胞内で触媒反応を引き起こすことが可能となる。
これまでに、生命に必要なCHNOPS元素群のうち、4つの元素の役割を概説した。しかしながら、これらの元素が生命に果たす役割は、まだ多く存在する。少数の例を挙げただけでも、これらの原子の適応性と生命のメカニズムの一部として細胞内で利用されている特性が明らかとなる。これらの原子が複雑な高分子化合物に利用されていることから、その有用性が明らかである。窒素、酸素、リン、そして硫黄が生命において重要な役割を果たしていることは明らかである。これらの元素が進化の過程で何度も用いられてきたという事実は、これらが随所に存在し、CHNOPSとしての地位を確立している証拠である。しかし、その他の元素については、本議論から除外してよいのだろうか。
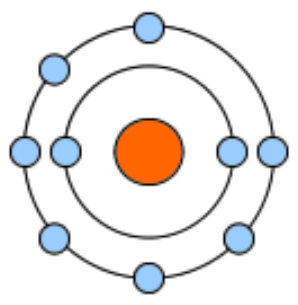
周期表において、化学的特性が類似する四つの元素を右方向に見ていくと、酸素の隣には『フッ素(F)』が存在する。フッ素は虫歯予防に効果的であるという理由から、少量が水道水に加えられているという事実により広く認知されている。しかし、生命体ではあまり活用されていない元素である。フッ素の電子殻はほぼ満たされており、最外殻には七個の電子が存在している。もし八個の電子が揃うと、四対のペアが形成される状態となる。
これら七個の電子は原子核に強く結びついている一方で、フッ素原子は電子殻を満たすための八個目の電子を強く求めている。この特性のため、フッ素は反応性が高く、他の原子と結合した際には容易には分離しない。炭素とフッ素の結合は、有機化合物において二番目に強い結合を示すが、反応性が低いため、生命体では大きな役割を果たしていない。
とはいえ、そんなフッ素原子も生物界で相手にされていないわけではない。熱帯地方には、フッ素化合物を毒として利用し、天敵を寄せ付けない植物や微生物が多く存在する。周期表におけるCHNOPS以外のすべての元素について言えることだが、特定の化学的特性を持つ化合物が生存競争に有利であるとわかれば、生命体はそれを利用するために進化する。しかしながら、フッ素の化学的性質は電子配置に起因するため、その用途は限定的であり、普遍的に生命体に利用されることはない。
周期表でフッ素の下に位置する『塩素』も、同様の問題を抱えている。フッ素より電子の数が多いので原子も大きく、電子殻の空白を満たす最後の一個を求める傾向はフッ素より小さいものの、それでも最後の一個を得ようとする性質はある。こうした傾向があるので、塩素も反応性が十分に高く、浴室の除菌に使う漂白剤の原料として活用されている。生命体から見捨てられているわけではなく、細胞内でイオンの濃度調整などの機能を果たしているが、その化学的特性から、塩素の利用範囲は限定的である。
それでは、窒素や酸素、リン、硫黄の下に位置する元素はどうか。リンの下には『ヒ素』、硫黄の下には『セレン』が存在する(図251参照)。どちらの元素も多種多様な生物に利用されており、生命体がどの元素も無視することはないことが明らかとなる。しかしながら、ヒ素もセレンもCHNOPS元素より原子が大きく、結果として電子の結合が弱く、他の原子との結合が容易に切断される。このような性質があるとはいえ、新たな生命体がその役割を探すための試行錯誤が行われていなかったわけではない。
周期表で下に位置するヒ素をリンの代わりに利用した場合、どうなるだろうか。ヒ素イオンを含んだDNAの結合の半減期(注212)はおよそ0.06秒と推定されるのに対し、リン酸塩を含んでいる場合、半減期は3000万年ほどまで一気に延びる(注213)。
(注212)ここで言及されている「半減期」は、化合物やその他の物質が半分に分解されるまでの時間を指す。
(注213)Fekry MI, Tipton PA and Gates KS, “Kinetic consequences of replacing the internucleotide phosphorus atoms in DNA with arsenic”, ACS Chemical Biology 6 (2011) 127-130.
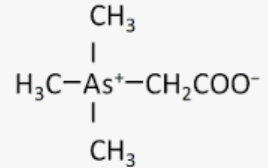
リン酸塩の代わりにヒ素がDNAを生化学的に維持しようとする場合、その細菌はきわめて特殊な環境か、大量のエネルギーが必要になる。これは、リン酸塩を含んだ他の分子にも当てはまる。ヒ素を利用する細菌というのは、もともとありえないような存在である。しかし、生命がヒ素を取り入れている事例は知られている。その具体的な用途はまだ明らかにされていないが、特定の海藻ではヒ素を含む糖が見つかっているし、魚や藻類、さらにはロブスターの一部でも、『アルセノベタイン』というヒ素化合物が確認されている。しかしながら、ヒ素は一般的に生物にとって有害である。電子を共有する傾向が強いため、他の分子に影響を及ぼし、それらと反応して代謝機能を混乱させる可能性がある。多くの生命体はヒ素の有害な影響を緩和あるいは排除する機構を持っている。
周期表でヒ素の隣に位置するセレンは、その上にある硫黄の代わりになりそうにも思える。この予測は生物で実際に確認されていて、生物において比較的珍しいアミノ酸の一つに、セレンが含まれていることがわかっている。それは、生命の21番目のアミノ酸と呼ばれる『セレノシステイン』(注214)である。
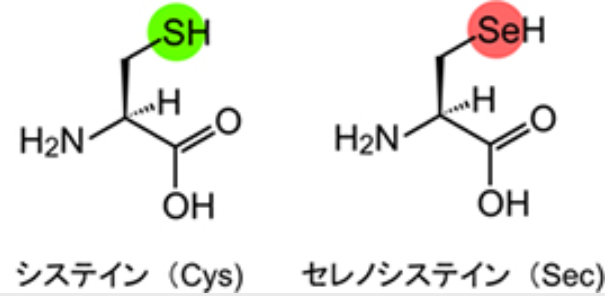
(注214)「セレノシステイン」とは、「システイン」の硫黄原子(S)がセレン原子(Se)に置換された構造を持つアミノ酸を指す。セレノシステインの生合成に関与する酵素は真正細菌、古細菌、真核生物の各種に存在しており、これは生体内におけるセレノシステインの重要性を示唆している。
特定のタンパク質にはこのセレノシステインが含まれていることが確認されている。セレノシステインの導入にはエネルギー投入と遺伝暗号の変化が必要であるため、生物が硫黄の代わりに偶然セレンを組み込んだのではないことがわかる。セレンは生物において重要な役割を果たしていることが確実である。グルタチオン還元酵素などのセレノシステインを含むタンパク質は、『酸素ラジカル』(注215)によるダメージを防ぐ機能を持つ。セレン原子は硫黄原子より大きく、電子をより易しく渡す性質を持つ。この特性が酸素ラジカルが持つ有害な自由電子を中和する作用に貢献している。セレン原子はこの重要な機能を果たした後、硫黄よりも容易に元の状態に戻り、同様の反応を再度行うことができる。これはセレンが硫黄よりも電子の取得や放出を容易にする性質から生じており、セレンはこの可逆性を持つためにそのような役割を果たすことができる。また、セレンを含むタンパク質は、多くの種類の化学反応で電子を失う『酸化』反応に対する耐性も高いことが示されている。
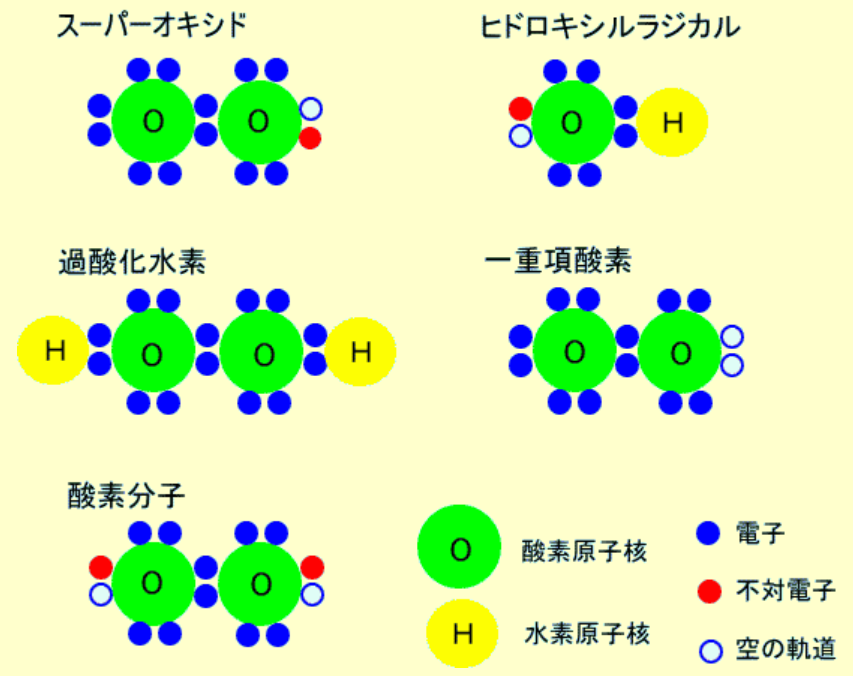
(注215)大気中に含まれる酸素分子がより反応性の高い化合物に変化したものを総称的に『活性酸素』といい、『スーパーオキシドアニオンラジカル(通称スーパーオキシドイオン・O2–』、『ヒドロキシルラジカルOH・』、『過酸化水素』、『一重項酸素』の4種類とされている。その中で、「スーパーオキシドアニオンラジカル」と「ヒドロキシルラジカル」は、一つの電子軌道に一つの電子(『不対電子』)しか存在せず、『フリーラジカル』と言われ、他の分子から電子を1ケ奪って、対になって安定しようとするので、他の分子を酸化させる。「過酸化水素」や「一重項酸素」はフリーラジカルではない。
同様の傾向がここでも観察される。ヒ素とセレンは生物によって避けられているわけではないが、それらの原子の大きさや電子の挙動が制約となり、広範な状況で利用できる能力を持っているわけではない。限定的な状況で特殊な役割を果たすだけである。
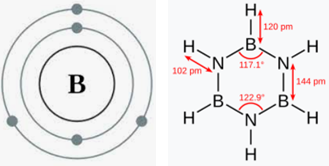
CHNOPS周辺の元素を調査する一環として、周期表において炭素に近い位置に存在する元素を見てみる価値がある。それは我々がこれまで注目してこなかった元素、『ホウ素』である。最外殻に三つの電子を持つこの小さな原子は他の元素と電子を共有できる。窒素と結合すると、環状の炭素化合物であるベンゼンに類似した『ボラジン』を形成する。ホウ素は炭素のように幅広い用途を持ってはいないが、CHNOPS元素の近くに存在する他の元素と同様に、生物に利用されていることが知られている。
数多くの動植物や微生物にとって必須な微量元素の一つであり、細胞膜の安定化や糖質の輸送などの機能を持つとされている(注216)。これは重要な役割である。ホウ素の欠乏は、リンゴやキャベツなどの農作物の不作を引き起こす一因となる重要な微量元素の欠乏症である。ホウ素は生物で多様な役割を果たしていると考えられているが、その知識はまだ十分ではない。
(注216)ホウ素の生物への輸送と生物内での役割は、ここ数年で分子レベルでの理解が深まりつつある。特に植物においては、受動的な輸送機構と能動的な輸送機構に関わる分子が同定されている。糖アルコールを転流する植物種では、ホウ素が糖アルコールとの複合体として植物体内を移動することが示されている。また、植物細胞壁に存在するペクチンとホウ素の結合が生育に必須であることが明らかになっている。さらに、酵母や動物においてもホウ素が細胞分裂や分化に重要であることが示されてきている。ヒトの健康に対するホウ素の役割についても研究が進められている。
植物の生長調節 ■ Regulation of Plant Growth & Development, 37 (2002), No 2,99−109.
ここまでの説明で、「生命を形成するうえでパウリの排他原理が果たしている役割」の概要が見えてきた。
- 核心となる役割を果たしているのは、安定した結合を形成するに適した電子構造を持つ一方で、その結合を適切に解くことで生命に有用な多種多様な化合物を生成できる元素である。炭素、窒素、酸素、リン、硫黄―これら五つの元素が主要であり、周期表においては一まとまりになっている。
- それに加えて、水素という小さな原子は、随時余剰な電子を確実に捕獲する。
- これらの元素は、原子の大きさや最外殻の電子数が適切であるため、互いに結合し、他の元素とも結合することで、自己複製する生命体の構築に適した「分子スープ」を生成する。
これら五つの元素の周囲には、化学的性質が類似している元素が存在する。しかし、
- 原子の大きさや電子の数が問題となり、生命にとって不可欠な分子を生成するには、安定性が少し不足したり、反応性がわずかに高すぎたりして、安定性と反応性の絶妙なバランスを達成することが難しい。
- これらの元素は、多様な役割を果たすのに理想的ではないが、化学的特性が特定の目的に適合する場合には利用される。
周期表の他の位置に存在する元素もまた、程度に違いはあれど、電子が何らかの有用な役割を果たす多くの場面で利用される。
- 「鉄」は、生命に必要なエネルギーを電子の移動と共に収集する機構において、中心的な役割を果たす(注217)。これは、生物の成長と繁殖に必要なエネルギーを周囲の環境から得る重要なプロセスである。
- 「バナジウム」や「モリブデン」などの元素は、タンパク質の反応を加速する補因子(コファクター)などで幅広く利用されている。
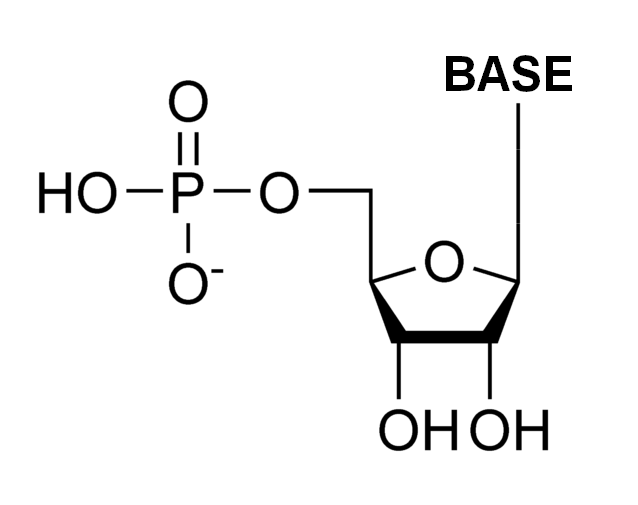
(注217)酸化還元反応は電子の受け渡し反応であり、細胞内で起こる多数の化学反応(「代謝」と総称される)の中で最も重要なものの一つである。この反応を触媒するタンパク質を「酵素」と呼ぶが、鉄は様々な酸化還元反応を触媒する酵素の活性中心として働いている。その代表的な酵素がリボヌクレオチド還元酵素(リダクターゼ)であり、鉄がなければ我々はDNAを合成することはできない。また、鉄は酸素輸送や呼吸鎖の最終電子受容体である酸素への電子供与にも関与し、エネルギー産生の重要な機能も担っている。
ナトリウムや亜鉛などの金属を含むCHNOPS以外の多くの元素は、塩を容易に形成する特性を持つ。食塩(塩化ナトリウム)を観察すれば明らかであるように、これらの原子は大きな構造を形成できるが、それらは特定の原子群が反復する単調な構造であり、生命の形成には適していないように見える。更に、地球の条件は、多種多様な結晶や塩を生み出すのに適しているが、45億年にわたる化学実験が続いてきたにもかかわらず、自己複製して進化する結晶はまだ発見されていない。
このように、進化の過程で周期表の元素がくまなく試され、生物の生存や繁殖の可能性を高める化学反応を促す電子配置を持った元素が選択されてきた。
しかし、生命は炭素以外の元素に基づいて構築できないのだろうか。生命の化学構造は普遍的なものなのだろうか。
生命を構成する分子群で炭素が主要な元素であるという特性に基づいて生命を分類するならば、地球上の生命は『炭素ベース』であると言える。しかし、生命は明らかに『周期表ベース』である。一部の環境に生息する生物は、他の生物よりもセレンを多く利用している。他の環境にはフッ素を含んだ生物もいるが、それ以外の環境ではそのような生物は見つかっていない。
生命は炭素に限定されているわけではない。生命の細胞は利用可能な元素をただ利用しているだけである。
- ここで重要な原理は、「自己複製して進化するシステムの構築に利用される元素は、生命体の完全性と継続性を保証する化学反応と結合が可能な電子配置を持つべきである」ということである。
- 地球で観察される条件や、宇宙で確認されている他の多くの環境では、水素や窒素、酸素、リン、硫黄と結合する性質を持つ炭素が、自己複製して進化するシステムの基本的なフレームワークを構築する。他の元素は、システムがより効率的に機能するように調整し、多様な分子を提供する役割を果たしている。
- 自然淘汰の過程において、さまざまな元素の用途は絶え間なく試されてきたし、現在も試されている。それにもかかわらず、炭素化合物の大半を他の種類の化合物と置き換える強い傾向を示した細胞は、まだ確認されていない。
低温や高温、多様な酸性度や圧力など、極限環境における多くの元素の挙動について知っているからこそ、他の物理条件下で、他の元素が炭素に代わって生命体に役立つ化合物群を生み出す可能性は低いと推測される。
どのような物理条件でも(少なくとも周期表にある原子が安定する条件では)、原子の基本的な電子配置が変わることはない。
- 反応の速度や、他の原子との相互作用の仕方は、環境によって変わるかもしれない。しかし、パウリの排他原理とそれが示唆する電子配置によって決まる主要な特性は不変である。
- 周期表で利用できる元素の種類が限られていることを考えると、宇宙のどのような惑星であっても、地球上での進化と同じように、生命は進化の過程で周期表の元素を順番に試して、同じ元素の組み合わせに行き着くと予想される。
- もちろん、地球上と同じように、どの元素を使用するかやその使用方法、生命体に含まれる量には大きなばらつきがあるだろうが、生命における主要元素の基本的な役割は、宇宙のどの銀河でもおそらく同じであるだろう。
「炭素が生命の構造で中心的な原子である理由」や「水が生命を機能させる溶媒である理由」、これらの理由を物理的原理で説明することにより、重要な結論に至る。
すなわち、「炭素と水に基づいた生命が普遍的である」という確信、および「物理的原理が生命のとりうる化学構造を制約する」という確信から、
- 液体窒素に適応したケイ素ベースの生命や、硫酸の雲で進化した酸耐性生命など、エイリアンの生化学的特性が存在する可能性がある
という考え方は完全には否定できないが、やはり、
現在の生命に対する見解としては、
- 炭素と水以外の元素や溶媒に基づく生命はありえず、ケイ素といった他の元素の化学的性質や、アンモニアといった他の溶媒の化学的性質は、宇宙にどれだけの量が存在していたとしても、生命の形成を促進する多様性の点で不足していると考える見方
に強く傾いているという状況である。
炭素化合物と水が豊富に存在するという事実から、宇宙の他の場所に生命が存在するとすれば、それは炭素と水に基づく可能性が高い。これまで示されたように、炭素化合物と水が宇宙全体に分布し、あらゆる種類の惑星に集まる傾向があることは、これら二つの物質が生命の材料として最も可能性が高いことを示している。
図表
図251 元素の周期表
フリー百科事典『ウィキペディア(Wikipedia)』「周期表」
(https://ja.wikipedia.org/wiki/%E5%91%A8%E6%9C%9F%E8%A1%A8)
図252 希ガス原子の電子配置
ワインを理解するための高校化学~無機化学編~
(https://cocos.co.jp/blog/others/chemistry-1/)
図253 炭素とケイ素の電子配置
多様なタンパク質の機構
(https://rarememory.com/protein2/protein2.htm)
図254 完全カゴ型構造シルセスキオキサン
東亞合成・製品情報「機能性材料 シルセスキオキサン誘導体」
(https://www.toagosei.co.jp/products/functional/adhesive/sq_series.html#:~:text=%E3%82%B7%E3%83%AB%E3%82%BB%E3%82%B9%E3%82%AD%E3%82%AA%E3%82%AD%E3%82%B5%E3%83%B3%EF%BC%88SQ,oxane%EF%BC%BD%E3%81%A8%E7%A7%B0%E3%81%95%E3%82%8C%E3%81%BE%E3%81%99%E3%80%82)
図255 ベンゾキノンの構造式
フリー百科事典『ウィキペディア(Wikipedia)』「キノン」
(https://ja.wikipedia.org/wiki/%E3%82%AD%E3%83%8E%E3%83%B3)
図256 バッキーボール
東京化成工業株式会社
(https://www.tcichemicals.com/JP/ja/c/12961)
図257 2つのアミノ酸が脱水縮合したペプチド結合の形成
フリー百科事典『ウィキペディア(Wikipedia)』「ペプチド結合」
(https://ja.wikipedia.org/wiki/%E3%83%9A%E3%83%97%E3%83%81%E3%83%89%E7%B5%90%E5%90%88)
図258 塩基対:グアニン-シトシン対
フリー百科事典『ウィキペディア(Wikipedia)』「塩基対」
(https://ja.wikipedia.org/wiki/%E5%A1%A9%E5%9F%BA%E5%AF%BE)
図259 DNAの構造
NS遺伝子研究室・DNAの基本構造〜ヌクレオチド〜
(http://nsgene-lab.jp/dna_structure/basic_structure/)
図260 アミロース(でんぷん)の分子構造
フリー百科事典『ウィキペディア(Wikipedia)』「でんぷん」
(https://ja.wikipedia.org/wiki/%E3%83%87%E3%83%B3%E3%83%97%E3%83%B3)
図261 酸化反応によるジスルフィド架橋の形成
フリー百科事典『ウィキペディア(Wikipedia)』「ジスルフィド結合」
(https://ja.wikipedia.org/wiki/%E3%82%B8%E3%82%B9%E3%83%AB%E3%83%95%E3%82%A3%E3%83%89%E7%B5%90%E5%90%88)
図262 ジスルフィド架橋の例
近畿大学 理工学部理学科化学コース 物理化学研究室 生物物理学
(https://www.chem.kindai.ac.jp/laboratory/phys/class/biophys/disulfide.htm)
図263 フッ素の電子配置
私立・国公立大学医学部に入ろう!ドットコム・化学講座・第2回:原子のつくり その(2)
(https://www.sidaiigakubu.com/examination-measure/chemistry/02/)
図264 塩素の電子配置
おでかけラボ・科学・塩素の電子式・電子配置・構造式を徹底解説!【同じ電子配置:電子殻】
(https://net-business888.com/cl2-denshisiki/)
図265 アルセノベタイン
第3回環境中ヒ素国際会議 (5月 台湾(台南)) 参加報告
(https://www.naro.affrc.go.jp/archive/niaes/magazine/125/mgzn12506.html)
図266 システインとセレノシステインの構造式
独立行政法人理化学研究所・研究成果(プレスリリース)2013
(https://www.riken.jp/press/2013/20130405_1/index.html)
図267 活性酸素の電子配置
脂質と血栓の医学・活性酸素と酸化ストレス・活性酸素・活性酸素の電子配置
(http://hobab.fc2web.com/sub2-dennsihaichi.htm)
図268 ホウ素の電子配置とボラジンの構造式
Techistoryネット・ホウ素
(http://www.techistory.net/math/index.php?page=429)
フリー百科事典『ウィキペディア(Wikipedia)』「ボラジン」
(https://ja.wikipedia.org/wiki/%E3%83%9C%E3%83%A9%E3%82%B8%E3%83%B3#:~:text=%E3%83%9C%E3%83%A9%E3%82%B8%E3%83%B3%20(borazine)%20%E3%81%AF%E3%80%81%E3%83%9B%E3%82%A6%E7%B4%A0,%E3%82%B6%E3%83%B3%20(cyclotriborazane)%20%E3%81%A8%E3%81%AA%E3%82%8B%E3%80%82&text=%E7%89%B9%E8%A8%98%E3%81%AA%E3%81%8D%E5%A0%B4%E5%90%88%E3%80%81%E3%83%87%E3%83%BC%E3%82%BF%E3%81%AF,kPa)%20%E3%81%AB%E3%81%8A%E3%81%91%E3%82%8B%E3%82%82%E3%81%AE%E3%81%A7%E3%81%82%E3%82%8B%E3%80%82)
図269 リボヌクレオチドの一般的な構造
フリー百科事典『ウィキペディア(Wikipedia)』「リボヌクレオチド」
(https://ja.wikipedia.org/wiki/%E3%83%AA%E3%83%9C%E3%83%8C%E3%82%AF%E3%83%AC%E3%82%AA%E3%83%81%E3%83%89)

